Ensayo PARTNER 1A – TAVI muestra resultados similares a sAVR1-3
- Un ensayo amplio y multicéntrico que reclutó a pacientes con estenosis aórtica severa (EAS) de riesgo alto y los aleatorizó a TAVI o sAVR
- La tasa de muerte (criterio de valoración principal) a 1 año fue no inferior con TAVI y sAVR
- TAVI mejoró significativamente al mes, a los 6 meses y a los 12 meses la puntuación de resumen general del KCCQ obtenida al inicio del estudio en pacientes que recibieron TAVI transfemoral
El diseño del estudio del ensayo PARTNER 1A1
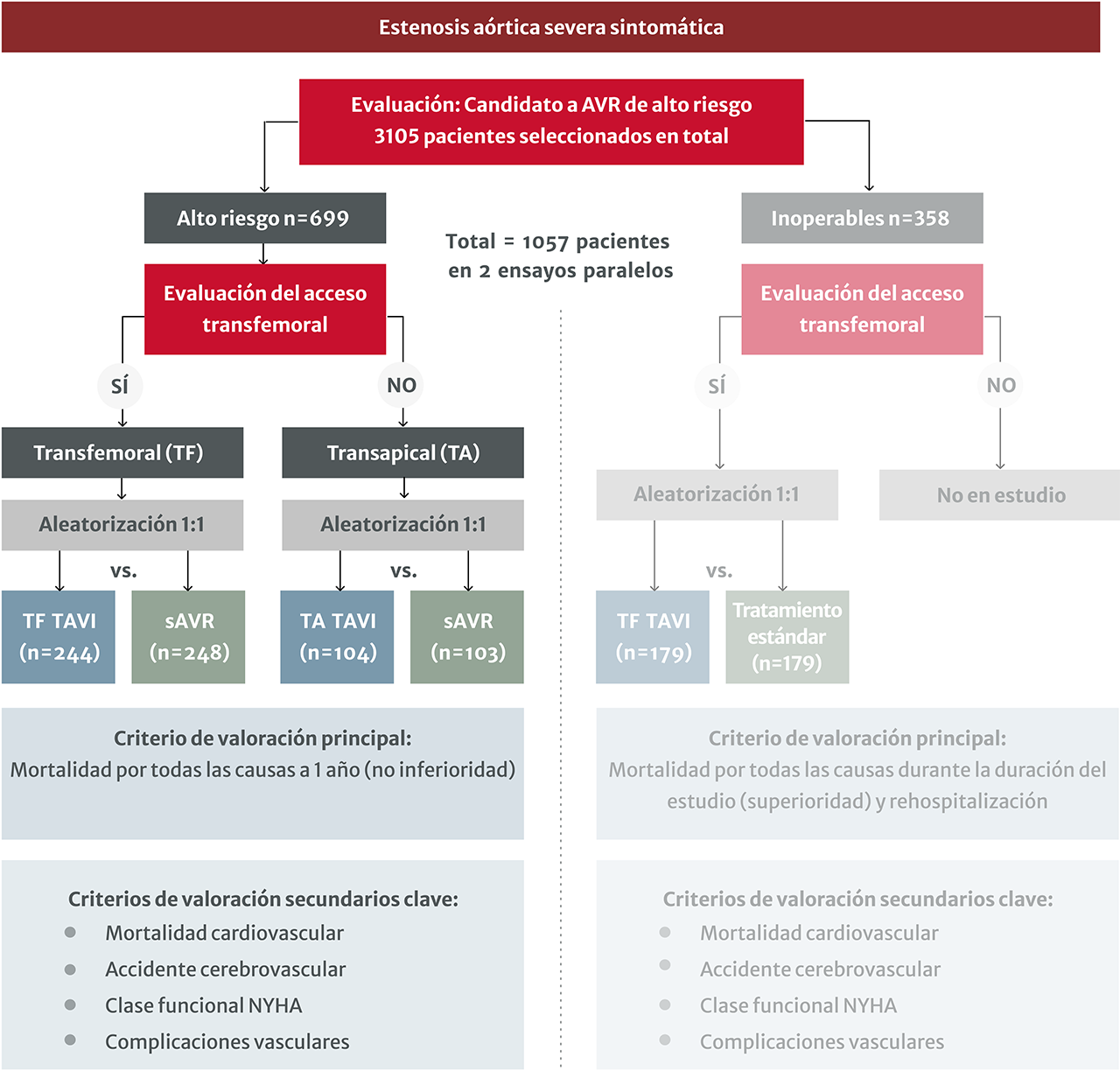
Criterios de inclusión y exclusión
Inclusiones1
- Estenosis severa de la válvula aórtica (área de la válvula aórtica <0,8 cm2 o gradiente medio >40 mmHg o velocidad máxima >4,0 m/s)
- Síntomas cardíacos (clase NYHA ≥II)
- Alto riesgo quirúrgico (riesgo de muerte o morbilidad grave irreversible de al menos el 15 % según la evaluación de un Heart Team de cardiólogos y cirujanos cardíacos – puntuación STS ≥10)
Exclusiones1
- Evidencia de un infarto agudo de miocardio ≤1 mes antes del tratamiento previsto
- La válvula aórtica es una válvula monocúspide congénita o bicúspide, o no está calcificada
- Enfermedad mixta de la válvula aórtica (estenosis aórtica e insuficiencia aórtica con insuficiencia aórtica predominante >3+)
- Cualquier procedimiento cardíaco invasivo terapéutico realizado dentro de los 30 días posteriores al procedimiento inicial (o 6 meses si el procedimiento fue un implante de stent coronario farmacoactivo)
- Válvula cardíaca protésica preexistente en cualquier posición, anillo protésico o insuficiencia mitral severa (superior a 3+)
Características al inicio
Las características de los pacientes de los grupos TAVI y sAVR se equilibraron al inicio del estudio de manera adecuada en términos generales.1*
* Los valores más/menos son medias ±DE.
† La puntuación en el modelo de riesgo de la Sociedad de Cirujanos Torácicos de EE. UU. (STS) utiliza un algoritmo que se basa en la presencia de enfermedades coexistentes para predecir la mortalidad operatoria a los 30 días. La puntuación STS es igual a la mortalidad prevista expresada como porcentaje. Menos del 5 % de los pacientes de la población en la que se basa el algoritmo STS tenían una mortalidad operatoria prevista (puntuación de riesgo) superior al 10 %.
‡ Para convertir los valores de creatinina a micromoles por litro, hay que multiplicar por 88,4.
Resultados clínicos y de pacientes registrados
Criterio de valoración principal con datos de seguimiento adicionales a los 5 años
A 1 año:1
- La mortalidad por todas las causas ocurrió en 84 pacientes (24,2 %) en el grupo TAVI frente a 89 pacientes (26,8 %) en el grupo sAVR (p=0,44)
A 5 años:2
- La mortalidad por todas las causas ocurrió en el 67,8 % de los pacientes en el grupo TAVI frente al 62,4 % de los pacientes en el grupo sAVR (p=0,76)
TAVI frente a cirugía en pacientes de alto riesgo2

* Seguimiento prolongado
Calidad de vida
Los pacientes que recibieron TAVI transfemoral disfrutaron de un mejor estado de salud a 1, 6 y 12 meses después del procedimiento respecto al inicio del estudio, medido con el KCCQ-OS (Kansas City Cardiomyopathy Questionnaire – Overall Summary).3

La rápida recuperación de TAVI transfemoral se asoció con beneficios a corto plazo en el estado de salud a 1 mes. Según la diferencia de puntuación a 6 y 12 meses, TAVI también proporcionó beneficios significativos para el estado de salud tardío.3
Datos reales
Registro SOURCE 35-7
- Se inscribieron 1950 pacientes con EAS de 80 centros de 10 países entre julio de 2014 y octubre de 2015
- Los criterios de inclusión incluyeron pacientes con EA severa, sintomática y calcificada, puntuación STS ≥8 y EuroSCORE logístico ≥15
- Con TAVI, la tasa de muerte a 30 días (criterio de valoración principal) fue baja (2,2 % en total, 1,9 % de acceso transfemoral frente a 4,0 % de acceso no transfemoral, p=0,0023)
Implicaciones clínicas
¿Qué podría significar una derivación a TAVI para sus pacientes que cumplen los criterios del ensayo PARTNER 1A?
- Para los pacientes con EAS de alto riesgo, TAVI ofreció posibilidades de supervivencia similares en comparación con sAVR, incluso después de cinco años de seguimiento1,2
- Esto podría suponer la diferencia entre una vida plena y una vida de sacrificios3
Manténgase al día con nuestro boletín
Gracias por inscribirse.
Se le ha enviado un correo electrónico de confirmación.
Al proporcionar su información personal, usted acepta que Edwards Lifesciences y sus agentes utilicen esta información para comunicarse con usted en el futuro, incluyendo información sobre productos, servicios, eventos y programas. Edwards Lifesciences y sus agentes no venderán, alquilarán ni distribuirán de ninguna otra manera su nombre y cualquier información personal identificable fuera de Edwards Lifesciences y sus agentes. Edwards Lifesciences utilizará su información de acuerdo con la política de privacidad de Edwards.
Nuestras actualizaciones mensuales le informan de los últimos avances en TAVI y estenosis
Referencias:
1 Smith CR et al. N Engl J Med 2011;364:2187-2198 and supplementary material.
2 Mack MJ et al. Lancet 2015;385:2477-2484.
3 Reynolds MR et al. J Am Coll Cardiol 2012;60:548–558.
4 Edwards Lifesciences. Data on File.
5 Wendler O et al. Circulation 2017;135:1123-1132.
6 Wendler O et al. Eur Heart J 2017;38:2717-2726.
7 ClinicalTrials.gov. Identifier: NCT02698956. Available from https://clinicaltrials.gov/ct2/show/NCT02698956 (accessed September 2020).
Producto Sanitario para uso profesional. Para obtener una lista de indicaciones, contraindicaciones, precauciones, advertencias y posibles eventos adversos, consulte las Instrucciones de uso (consulte e.ifu.edwards.com cuando corresponda). Todos los productos sanitarios de Edwards Lifesciences puestos en el mercado español cumplen la legislación vigente.
PP–EU-2288 v2.0