- Los pacientes buscan procedimientos que les ayuden a mejorar su calidad de vida y volver a sus actividades cotidianas1
- El uso eficiente de los recursos hospitalarios es cada vez más importante en el tratamiento de los pacientes tras un remplazo valvular aórtico (AVR)2,3
- En comparación con la cirugía (sAVR), TAVI reduce la duración de la estancia hospitalaria, aumenta las altas directamente al domicilio, acorta el tiempo del procedimiento y reduce la rehospitalización4
Objetivos del paciente y del hospital para el remplazo valvular aórtico
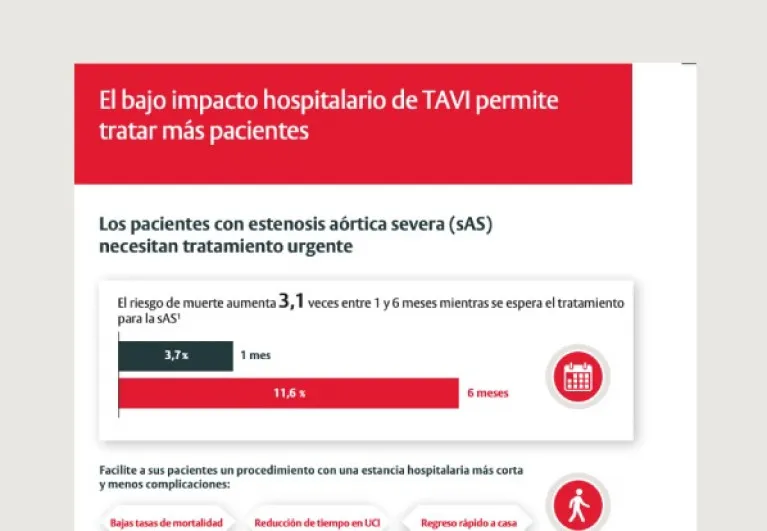
Después de la AVR, los pacientes quieren evitar complicaciones, volver a casa y reanudar su vida cotidiana.1 Un alta temprana puede ayudar a mejorar los resultados y la calidad de vida de los pacientes, además de ahorrar en recursos hospitalarios.5
¿Puede TAVI facilitarnos la consecución de estos objetivos?
Además de resultados clínicos superiores* de TAVI frente a sAVR, los datos del ensayo PARTNER 3 demostraron:4
- Una estancia hospitalaria 4 días más corta
- Una mayor proporción de pacientes dados de alta al domicilio o con capacidad de cuidarse a sí mismos
- Menos complicaciones que conducen a la rehospitalización
- Una estancia de 1 día más corta en cuidados intensivos
- Un tiempo de procedimiento acortado en más de 2 horas
*En el ensayo PARTNER 3 se demostró que SAPIEN 3 TAVI es superior a la cirugía según el criterio de valoración principal y según varios criterios de valoración secundarios previamente especificados.
Beneficios probados por encima de sAVR, tanto para el paciente como para la atención sanitaria
Menos complicaciones, tiempos de procedimiento más cortos y estancias hospitalarias reducidas pueden ayudar a reducir la carga en los recursos de atención médica limitados.4
 Para obtener más detalles, consulte el ensayo PARTNER 3
Para obtener más detalles, consulte el ensayo PARTNER 3
Alta hospitalaria rápida después de TAVI demostrada en estudios de la práctica real
Los datos de 3M TAVR y FAST-TAVI, dos estudios de la práctica real que buscan optimizar las sendas de altas de pacientes después de TAVI, demostraron:3,6

El alta hospitalaria temprana al domicilio puede ayudar a mejorar la calidad de vida del paciente, ahorrar en recursos hospitalarios y reducir los costes de tratamiento.
Ver detalles sobre los beneficios de TAVI para la calidad de vida† Combinación de mortalidad por todas las causas o accidente cerebrovascular a 30 días.
‡ Combinación de mortalidad por todas las causas, complicaciones relacionadas con el acceso vascular, implante de marcapasos permanente, accidente cerebrovascular, rehospitalización por causas cardíacas, insuficiencia renal y hemorragia importante a 30 días.
Manténgase al día con nuestro boletín
Gracias por inscribirse.
Se le ha enviado un correo electrónico de confirmación.
Al proporcionar su información personal, usted acepta que Edwards Lifesciences y sus agentes utilicen esta información para comunicarse con usted en el futuro, incluyendo información sobre productos, servicios, eventos y programas. Edwards Lifesciences y sus agentes no venderán, alquilarán ni distribuirán de ninguna otra manera su nombre y cualquier información personal identificable fuera de Edwards Lifesciences y sus agentes. Edwards Lifesciences utilizará su información de acuerdo con la política de privacidad de Edwards.
Nuestras actualizaciones mensuales le informan de los últimos avances en TAVI y estenosis
Referencias:
1 Coylewright M, et al. Health Expect. 2016;19(5):1036-1043.
2 Arora S, et al. Circ Cardiovasc Interv. 2018;11(9):e006929. doi:10.1161/ CIRCINTERVENTIONS. 118.006929.
3 Barbanti M, et al. Eurointervention 2019;5:147-154.
4 Mack M et al. N Engl J Med 2019;380:1695-1705 and supplementary material.
5 Barbanti M, et al. Heart. 2015;101:1485–1490.
6 Wood D, et al. JACC: Cardiovascular Interventions 2019;12(5):459-469.
Producto Sanitario para uso profesional. Para obtener una lista de indicaciones, contraindicaciones, precauciones, advertencias y posibles eventos adversos, consulte las Instrucciones de uso (consulte e.ifu.edwards.com cuando corresponda). Todos los productos sanitarios de Edwards Lifesciences puestos en el mercado español cumplen la legislación vigente.
PP–EU-2291 v2.0